Заживление ран
Оригинальное название статьи: Wound repair and regeneration.
Авторы: J. M. Reinke, H. Sorg.
Аннотация
Кожа — это самый большой орган человеческого тела, выполняющий множество функций. Ввиду этого заживление кожной раны демонстрирует экстраординарный механизм каскадирования клеточных функций, уникальный по своей природе. Поскольку процессы заживления и регенерации происходят во всех частях человеческого тела, в этом обзоре мы заострим свое внимание конкретно на процессах заживления кожи и выделим классические фазы заживления ран. В то время как под регенерацией подразумевают специфическое замещение ткани, будь то поверхностный эпидермис, слизистая оболочка или кожа плода, восстановление кожи происходит за счет неспецифической формы восстановления, при которой рана заживает с помощью фиброза и образования рубцов.
Первый этап заживления острой раны посвящен гемостазу и формированию временного матрикса, который происходит сразу после травмы и завершается через несколько часов. Кроме того, эта фаза инициирует воспалительный процесс. Воспалительный этап заживления ран активируется во время фазы коагуляции, и его можно условно разделить на раннюю фазу (с рекрутированием нейтрофилов) и позднюю (с появлением и трансформацией моноцитов). На этапе пролиферации основное внимание процесса заживления направлено на восстановление поверхности раны, формирование грануляционной ткани и восстановление сосудистой сети. Поэтому, наряду с миграцией локальных фибробластов по фибриновой сети и началом реэпителизации, на краях раны активизируются процессы неоваскуляризации и ангиогенеза за счет прорастания капилляров. Процесс образования грануляционной ткани прекращается из-за апоптоза клеток, характеризующего зрелую рану как аваскулярную и ацеллюлярную. В процессе созревания раны компоненты внеклеточного матрикса претерпевают определенные изменения. Физиологический результат заживления ран у млекопитающих проявляется образованием рубца, который непосредственно связан со степенью воспаления на протяжении всего процесса заживления раны.
Содержание
Введение
Целостность внешней оболочки — одна из важнейших черт, которая встречается как у простых бактерий, так и у сложных многоклеточных организмов. Более того, способность организмов исцелять или регенерировать ткани для восстановления функций органов была и остается селективным преимуществом и фактором выживания в природе. Поскольку большинство организмов подвержены непрерывному процессу обновления на протяжении всей жизни, способность к исцелению у различных видов проявляется по-разному, начиная от простого восстановления тканей до регенерации целых органов, как, например, у аксолотлей (ambystoma mexicanum). Заживление ран, означающее на самом же деле заживление кожи, было признано важным для здоровья человека еще с незапамятных времен. Свитки папируса из древнего Египта (3200–300 гг. до н. э.) уже на тот момент описывали процедуры ухода за ранами с использованием компрессов для улучшения гемостаза. Они также описывают методы перевязки ран Гиппократа и Галена, указывая на важность дренажа гноя из раны («Ubi pus, ibi evacua»), а также изображая принципы заживления ран закрытым и открытым способом. Однако большая часть этих знаний со временем была утрачена и заново открыта уже в современную эпоху Бруншвигом, фон Герсдорфом и Парацельсом. И только в конце 19-го века благодаря развитию антисептики Листером и Земмельвейсом, обнаружению патогенных микроорганизмов Кохом и особенно открытию пенициллина Флемингом и сульфаниламидов Домагком, которые оказали огромное влияние на понимание, терапию и исход заживления ран, мы смогли приблизиться к тому, что мы знаем сейчас. В настоящее же время исследователи фокусируются на более глубоком понимании взаимодействия клеток и их влияния различных цитокинов и факторов роста, а также раскрывают процесс заживления кожных ран на молекулярно-биологическом уровне. Но даже после 5000 лет лечения ран цели не изменились. Рану нужно закрыть быстро, соблюдая все антисептические нормы, но в то же время результат должен быть эстетичным, без образования каких-либо шрамов или других осложнений. Поскольку процессы заживления и регенерации происходят во всех частях человеческого тела, в этом обзоре мы заострим свое внимание конкретно на процессах заживления кожи и выделим классические фазы заживления ран.
Физиология заживления кожных ран у взрослых
Заживление кожных ран — это динамичный и жестко регулируемый процесс клеточных, гуморальных и молекулярных механизмов, который начинается непосредственно после ранения и может длиться годами. Любое нарушение нормальной анатомической структуры ткани с последовательной потерей функции может быть описано как рана. Повреждения покровов определяются как открытые или наружные раны, тогда как внутренние или закрытые раны описывают повреждения или разрывы внутренних органов и тканей с еще неповрежденной кожей. Закрытие кожной раны может быть осуществлено путем регенерации или заживления. Тогда как под регенерацией подразумевают специфическое замещение ткани, будь то поверхностный эпидермис, слизистая оболочка или кожа плода, восстановление кожи происходит за счет неспецифической формы регенерации, при которой рана заживает с помощью фиброза и образования рубцов. Последнее, к сожалению, является основной формой заживления кожных ран у взрослых людей. Процесс заживления кожных ран часто описывают как игру оркестра или как действия в спектакле, в которых взаимодействие клеток, факторов роста и цитокинов заканчивается восстановлением кожного покрова. Согласно недавним исследованиям, даже если этот деликатный баланс между клетками и медиаторами нарушается, дефицит одного типа клеток или отсутствие медиатора может быть компенсирован другими, участвующими в заживлении раны, так что процесс заживления по-прежнему возможен. Процесс заживления ран можно искусственно разделить на три-пять фаз, которые накладываются друг на друга во времени и пространстве. Цель данного обзора — подробно осветить реальные процессы, задействованные при заживлении кожных ран.
Реакция сосудистой системы: гемостаз и коагуляция
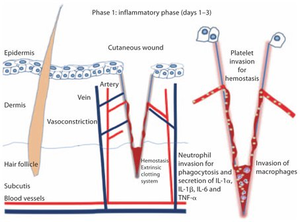
Первый этап заживления острой раны посвящен гемостазу и формированию временного матрикса, который происходит сразу после травмы и завершается через несколько часов. Кроме того, эта фаза инициирует воспалительный процесс. Иногда эту фазу также называют «лаг-фазой», в которой организму приходится рекрутировать множество клеток, а также контролировать факторы, важные для процесса заживления при небольших разрывах ткани. При травме кожи, выходящей за пределы эпидермального слоя, травмируются кровеносные и лимфатические сосуды, вымывая тем самым различные микроорганизмы и антигены из раны. Другие же каскады свертывания инициируются коагулирующими факторами из поврежденной кожи (внешняя система), после чего активируются тромбоциты для агрегации открытым коллагеном (внутренняя система). В то же время поврежденные сосуды подвергаются вазоконстрикции (5-10 минут), вызванной тромбоцитами, чтобы уменьшить кровопотерю и заполнить тканевую щель тромбом, состоящим из цитокинов и факторов роста. Кроме того, сгусток крови содержит молекулы фибрина, фибронектина, витронектина и тромбоспондинов, образуя временный матрикс как каркасную структуру для миграции лейкоцитов, кератиноцитов, фибробластов и эндотелиальных клеток, а также как резервуар факторов роста. Такая спасительная вазоконстрикция с образованием тромба обусловливает локальную недостаточность перфузии при последовательном недостатке кислорода, усилении гликолиза и изменении рН. Затем за вазоконстрикцией следует вазодилатация, при которой тромбоциты вторгаются во временный матрикс раны. Более того, тромбоциты влияют на инфильтрацию лейкоцитов путем высвобождения хемотаксических факторов. Как тромбоциты, так и лейкоциты высвобождают цитокины и факторы роста для активации воспалительного процесса (IL-1α, IL-1β, IL-6 и TNF-α), стимулируют синтез коллагена (FGF-2, IGF-1, TGF-β), активируют трансформацию фибробластов в миофибробласты (TGF-β), запускают процесс ангиогенеза (FGF-2, VEGF-A, HIF-1α, TGF-β), тем самым поддерживая процесс реэпителизации (EGF, FGF-2, IGF-1, TGF-α) [10]. Вазодилатацию также можно распознать по местному покраснению (гиперемии) и отеку.
Воспалительная фаза после пореза кожи; гемостаз и инвазия воспалительных клеток.
Клеточная реакция: воспаление
Воспалительный этап заживления ран активируется во время гемостаза и фазы коагуляции, его можно условно разделить на раннюю фазу с рекрутированием нейтрофилов и позднюю с появлением и трансформацией моноцитов (рис. 1). Благодаря реакции комплекса защитных белков (системы комплемента), дегранулированных тромбоцитов и побочных продуктов бактериальной деградации нейтрофилы рекрутируются в место повреждения кожи и находятся там в течение 2-5 дней, если рана не инфицируется. Работа нейтрофилов играет решающую роль в первые дни после травмы, поскольку их способность к фагоцитозу и секреции протеаз помогает убивать местные бактерии и способствует деградации некротических тканей. Также они действуют как хемоаттрактанты для других клеток, вовлеченных в воспалительную фазу.
Нейтрофилы высвобождают медиаторы, такие как TNF-α, IL-1β и IL-6, которые усиливают воспалительную реакцию и стимулируют VEGF и IL-8 для создания надлежащей репаративной реакции. Кроме того, они начинают свою очистку пораженных участков с высвобождения высокоактивных антимикробных веществ (катионных пептидов и эйкозаноидов) и протеиназ (эластаз, катепсин G, протеиназ 3 и активатор плазминогена урокиназного типа). Исследования «In vitro» также показали, что нейтрофилы могут изменять фенотип и характер цитокинового профиля макрофагов, что приводит к природному иммунному ответу во время заживления.
Примерно через 3 дня после травмы макрофаги попадают в зону повреждения и оказывают поддержку текущему процессу, осуществляя фагоцитоз патогенов и клеточного мусора, а также секрецию факторов роста, хемокинов и цитокинов. Помимо фактической поддержки в заживлении раны, эти молекулы стараются сохранить процесс заживления нетронутым, так как некоторые из них способны активировать следующую фазу заживления (пролиферативную фазу). Воспалительная реакция на повреждение необходима для подачи сигналов факторам роста и цитокинам, ответственным за движение клеток и тканей, которые играют ключевую роль в последующих механизмах репарации у взрослых млекопитающих. Есть данные о том, что степень воспаления определяет размеры будущего рубца. Плюс ко всему, отсутствие внутриутробного воспаления приводится в качестве доказательства теории безрубцового заживления ран у плода.
Макрофаги выполняют множество функций, включающие в себя защиту организма, регулирование процессами воспаления, удаление апоптотических клеток и поддержку клеточной пролиферации, а также восстановление тканей после травмы. Помимо своих иммунологических функций в качестве антигенпрезентирующих клеток и фагоцитов во время заживления ран, макрофаги предположительно играют важную роль в заживлении за счет синтеза многочисленных факторов роста, таких как TGF-β, TGF-α и основных FGF, PDGF и VEGF, которые способствуют пролиферации клеток и синтезу молекул внеклеточного матрикса (ECM) резидентными клетками кожи.
Пролиферация и заживление
Реэпителизация/Обновление кожи
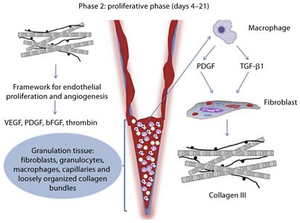
На этапе пролиферации (примерно через 3-10 после травмы) основное внимание процесса заживления направлено на восстановление поверхности раны, формирование грануляционной ткани и восстановление сосудистой сети. Поэтому наряду с миграцией локальных фибробластов по фибриновой сети и началом реэпителизации на краях раны активизируются процессы неоваскуляризации и ангиогенеза за счет прорастания капилляров. Под контролем регулирующих цитокинов, таких как IFN-γ и TGF-β, синтез коллагена, фибронектина и других веществ, необходимых для заживления раны за счет фибробластов, представляют собой основу для нового матрикса соединительной ткани, служащего для закрытия тканевых разрывов и восстановления прочности тканей раны. Впоследствии синтез коллагена увеличивается по всей ране, в то время как распространение фибробластов последовательно снижается, регулируя баланс между синтезом и деградацией внеклеточного матрикса.
Процесс реэпителизации обеспечивается локальными кератиноцитами по краям раны и эпителиальными стволовыми клетками волосяных фолликулов или потовых желез. Этот процесс активируется сигнальными путями эпителиальных и неэпителиальных клеток по краям раны, которые высвобождают мириады различных цитокинов и факторов роста, например EGF, KGF, IGF-1 и NGF. Кроме того, отмена контактного ингибирования и физического напряжения в десмосомах и гемидесмосомах продуцирует липидные медиаторы и активирует мембраносвязанные киназы (SRC-киназы), что приводит к повышению проницаемости мембран для ионов, например, того же кальция. Это выводит инициирующий сигнал на клетки по краям раны с последующей ретракцией и перестройкой их внутриклеточных тонофиламентов в направлении миграции. При ферментативном разрыхлении межклеточных десмосом с помощью коллагеназы и эластазы активированные кератиноциты мигрируют вдоль предварительно сформированного фибринового сгустка крови в более высокие слои грануляционной ткани. Этот процесс называется «перетасовкой» кератиноцитов, который описывает способность данных клеток конкурентно мигрировать вдоль хемотаксического градиента, созданного медиаторами, такими как IL-1, и через богатый фибронектином матрикс в центр раны. Ламеллиподиальное движение выполняет саму миграцию и направляется в место дефекта за счет полимеризации цитоскелетных актиновых волокон в наросте и образования новой фокальной адгезии во внеклеточном матриксе, опосредованной интегринами. Эти цитоскелетные механизмы регулируются Rho ГТФазами (Rho, Rac, Cdc42). Малые ГТФазы являются переносчиками внутриклеточного объединения волокон и необходимы для организованного процесса эпителизации, а также прекращения миграции. Этот процесс продолжается до тех пор, пока мигрирующие клетки не коснутся друг друга. Тогда, вероятно, ГТФазы будут отключены, что приведет к реорганизации цитоскелета. Слияние противоположных эпителиев реализуется за счет деградации актиновых волокон в филоподиях, которые заменяются межклеточными адгезионными контактами, чтобы окончательно закрыть рану по принципу замка-молнии.
Неоваскуляризация/Ангиогенез
Восстановление сосудистой системы кожи представляет собой сложный каскад клеточных, гуморальных и молекулярных событий, происходящих на поверхности раны для повторного подключения сосудистой системы к питательной перфузии. Инициаторами являются факторы роста, например, VEGF, PDGF, bFGF и сериновая протеаза тромбин. Первым шагом в формировании новых сосудов является соединение факторов роста с их рецепторами на эндотелиальных клетках существующих сосудов, тем самым активируя внутриклеточные каскады сигналов. Активированные эндотелиальные клетки выделяют протеолитические ферменты, которые растворяют базальную пластинку. Таким образом, эндотелиальные клетки теперь способны распространяться и мигрировать в рану, образуя тем самым процесс, также известный как «прорастание». Эндотелиальные клетки ориентируются на поверхностные молекулы адгезии, например, интегрины (avβ3, avβ5, α5β1). Кроме того, они высвобождают матриксные металлопротеиназы на фронте пролиферации, лизируя окружающие ткани для поддержания процесса эндотелиальной пролиферации. Вновь созданные «ростки» образуют небольшие трубчатые каналы, которые соединяются с другими, образуя сосудистые петли. После этого новые сосуды дифференцируются в артерии и венулы и созревают путем стабилизации их сосудистой стенки за счет рекрутирования перицитов и гладкомышечных клеток. Наконец начальный кровоток завершает ангиогенный процесс. При нормальной толщине кожи раны процесс неоваскуляризации протекает по четкой схеме. Сначала сосуды образуют внутреннее кольцо из циркулярно расположенных сосудов по краю раны, за которыми следуют внешние радиально расположенные сосуды, питающие внутренние. Поскольку конструкция сосудов похожа на солнце, ее также еще называют «sola cutis se reficientis». По мере закрытия раны внутреннее сосудистое кольцо сжимается, что приводит к полному исчезновению сосудистого кольца. Однако радиально расположенные сосуды соединяются друг с другом, со временем образуя новую кожную сосудистую сеть.
Образование грануляционной ткани
Последним этапом фазы пролиферации является образование грануляционной ткани (рис. 2). В то же время начинается фаза ремоделирования. В качестве промежуточной ткани она заменяет собой временный матрикс на основе фибрина/фибронектина и может образовывать рубец при созревании. Более того, он характеризуется высокой плотностью фибробластов, гранулоцитов, макрофагов, капилляров и слабо организованных коллагеновых пучков (рис. 2). Из-за такого большого количества клеточных соединений ее и называют грануляционной тканью. Поскольку ангиогенез еще не полностью завершен, эта ткань наполнена большим количеством сосудов. В результате ее появление можно определить по классическому покраснению и высокой травматичности. Однако доминирующей клеткой в этой фазе является фибробласт, который выполняет различные функции, такие как выработка коллагена и веществ внеклеточного матрикса (например, фибронектина, гликозаминогликанов, протеогликанов и гиалуроновой кислоты). Формирование внеклеточного матрикса является еще одним важным шагом, поскольку он обеспечивает каркас для клеточной адгезии и четко регулирует и организует рост, движение и дифференцировку клеток внутри него. Таким образом, фибробласт является предшественником временного матрикса, на котором и в котором происходит соответствующая миграция и организация клеток. К концу этого этапа количество созревающих фибробластов уменьшается за счет дифференцировки миофибробластов, после чего полностью прекращается последовательным апоптозом.
Пролиферативная фаза; организация тромба, секреция факторов роста, синтез коллагена III и начало ангиогенеза.
Ремоделирование
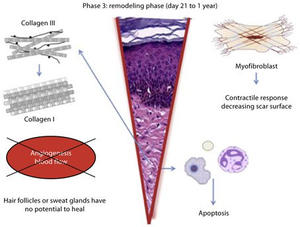
Ремоделирование является финальным этапом заживления и может наблюдаться с 21-го дня и до 1-го года после травмы. Процесс образования грануляционной ткани прекращается за счет апоптоза клеток, характеризующего зрелую рану как аваскулярную и ацеллюлярную. В процессе созревания раны компоненты внеклеточного матрикса претерпевают определенные изменения. Коллаген III, который вырабатывался на этапе пролиферации, теперь заменяется более сильным коллагеном I (рис. 3). Этот тип коллагена формируется в виде небольших параллельных пучков, следовательно, он отличается от «корзинчатого» коллагена, который мы можем наблюдать в здоровой дерме. В дальнейшем миофибробласты вызывают сокращение поверхности раны путем многократного прикрепления к коллагену и способствуют уменьшению поверхности развивающегося рубца. Кроме того, в ране падает активность ангиогенных процессов, снижается кровообращение, метаболическая активность замедляется, и, наконец, полностью останавливается.
Фаза ремоделирования; регенеративные процессы угасают и сопровождаются реорганизацией соединительной ткани и сократительными реакциями.
В отличие от заживления ран плода, существуют определенные компоненты кожи, которые никогда полностью не восстанавливаются после закрытия раны. Субэпидермальные придатки, такие как волосяные фолликулы или потовые железы, не могут полностью заживать и заново вырастать после серьезной травмы. Эпидермис образовавшегося рубца отличается от такового на неповрежденной коже после заживления раны из-за отсутствия эпидермальных петлевидных выростов, которые обычно закрепляются в матриксе из соединительной ткани и отвечают за плотное соединение эпидермиса с дермой.
Заживление ран плода
В отличие от тканей взрослого человека и их реакции на травму, плод на ранних сроках беременности обладает способностью заживать без образования рубцов. Этот уникальный процесс исцеления был впервые обнаружен в 1979 году, и впоследствии его существование подтвердили многие испытания на животных и людях. В процессе испытаний склонность к безрубцовому заживлению ран наблюдалась у плодов крыс, мышей, свиней, обезьян и людей, она является зависимой от возраста чертой у различных видов. Безрубцовое заживление у людей может проявляться вплоть до 24-й недели беременности, тогда как у мышей оно становится невозможным уже на 18,5-й день (период беременности у мышей: 20 дней). Точный день определяется размером раны; более крупные повреждения могут оставить шрам раньше, чем небольшая царапина. Структура и гистология кожи плода быстро меняются во время беременности. В течение первых 20 дней плод покрыт лишь примитивным эпидермисом, который развивается в двухслойную перидерму и базальный клеточный слой в течение 4-8 недель. На 9-й неделе начинается процесс расслоения эпидермиса плода, а на 14-й — ороговения. К тому времени, когда плод достигает 16-й недели, в его эпидермисе уже имеются многие компоненты взрослого эпидермиса: базальный слой, промежуточный слой, волосяные фолликулы, потовые железы и фолликулярная кератинизация. После 24 недель процессы быстрого роста и созревания начинают преобладать в плоде над другими, и к моменту рождения кожа новорожденного становится неотличима от кожи взрослого. В качестве ответа на повреждение тканей дермы у плода имеется способность регенерировать незатронутый коллагеновый матрикс, идентичный по структуре исходной ткани. Любопытным является то, что даже кожные придатки, такие как сальные железы и волосяные фолликулы плода, нормально заживают после травмы. Имеются данные о том, что безрубцовое заживление тканей плода обусловлено различиями во внеклеточном матриксе, воспалительной реакции, клеточных медиаторах, дифференциальной экспрессии генов и функциями стволовых клеток. Воспалительная реакция в эмбриональной ране состоит из гораздо меньшего количества менее дифференцированных клеток (нейтрофилов, моноцитов и макрофагов), что в сочетании с совершенно другим профилем факторов роста способствует гораздо лучшему заживлению ран в ткани плода. Также продолжительность присутствия воспалительной клетки уменьшается в сравнении с ранами у взрослых. Молекулярные изменения включают в себя низкие уровни TGF-β1, TGF-β2, PDGF и высокие уровни TGF-β3. Из-за быстро развивающегося и растущего объема кожи ткань плода содержит в себе множество высокоуровневых морфогенетических факторов, которые участвуют в росте кожи, ремоделировании и морфогенезе. Эти два принципа — сниженная воспалительная реакция и изменение морфогенеза кожи — приводят к тому, что в отношении временном, качественном и количественном профиль фактора роста у плода отличается от такового у взрослого во время заживления раны.
Рубцевание
Физиологический результат заживления ран у млекопитающих проявляется образованием рубца, который непосредственно связан со степенью воспаления, что подтверждается многочисленными свидетельствами. Первым из таких свидетельств является то, что при заживлении ран у плода отсутствует типичная воспалительная реакция, и ткани могут заживать без рубцов до определенного возраста. Более того, процесс образования рубцов, по-видимому, может продлеваться, если в ране плода индуцируется воспаление. Вторым примером, указывающим на роль воспаления в формировании рубцов, является влияние на этот процесс половых гормонов. Исследования показали, что низкий уровень эстрогена у мышей приводит к нарушению скорости процесса заживления, включая чрезмерное воспаление и рубцевание.
Большинство незаживающих ран не проходят через нормальные этапы заживления, а лишь остаются в хроническом воспалительном состоянии, что приводит к аномальному и чрезмерному «заживлению» раны, например, к гипертрофическим или келоидным рубцам. Келоиды содержат толстые коллагеновые волокна, тогда как гипертрофические рубцы состоят из тонких волокон, которые собраны в узелки. Изменения в созревании коллагена напрямую влияют на чрезмерное образование рубцов. Грануляционная ткань продолжает расти из-за чрезмерной секреции факторов роста и отсутствия молекул, необходимых для апоптоза или ремоделирования внеклеточного матрикса. Гипертрофические рубцы содержат избыточные микрососуды, которые в основном окклюзируются из-за чрезмерной пролиферации и функциональной регрессии эндотелиальных клеток, индуцированных гиперактивностью миофибробластов и излишней выработкой коллагена.
Также сообщалось о фокальной регуляции экспрессии р53, которая, по-видимому, играет важную роль в ингибировании апоптоза, в ситуациях чрезмерного рубцевания. Кроме того, механическое раздражение в ранней пролиферативной фазе приводит к гипертрофическим рубцам, ингибируя тем самым апоптоз.
Изменения во внеклеточном матриксе и эпителии, по всей видимости, также влияют на чрезмерное рубцевание. Была предложена гипотеза нейрогенного воспаления: механический стресс стимулирует механочувствительные ноцицепторы в сенсорных волокнах кожи, которые высвобождают нейропептиды, участвующие в модификации сосудов и активации фибробластов. Чрезмерное рубцевание — это фиброзное расстройство, возникающее в результате нарушения нормального процесса заживления ран.
Заключение и прогнозы
Регуляция клеточных функций во время восстановления кожи после травмы сложна и зависит от взаимодействия клеток с внеклеточным матриксом, чья работа может быть нарушена на любом из этапов и в любой момент процесса заживления раны. Многие действия клеток или цитокинов могут быть приняты другими без серьезного вмешательства в процесс заживления. Однако любые незначительные действия могут играть решающее значение, точно так же как множественные нарушения при заживлении могут привести к хроническим или незаживающим ранам. Исследования в этой специализированной области все еще продолжаются, и многие вопросы до сих пор остаются без ответа. Впрочем, более глубокое понимание этого сложного взаимодействия поможет создать основу для разработки новых и более эффективных методов заживления ран. Знания, полученные в результате изучения генетических и молекулярных путей, цитокиновых взаимодействий и факторов влияния, а также колоссальное развитие в создании новых перевязочных материалов для консервативной терапии ран, в будущем помогут снизить частоту образования незаживающих ран, а также улучшить качество заживления в плохих условиях. Кроме того, благоприятные результаты в терапии стволовыми клетками, а также в тканевой инженерии открывают новые терапевтические возможности для заживления кожных ран.